Leuchter, Rudolf
et les bleus de Prusse
Richard J. Green
Traduction française de Franck Canorel (mars 2012)
Annexe I
L’absorption par l’eau et la loi de Henry
La page 32 du livre de DuPont intitulée Hydrogen Cyanide: Properties, Uses, Storage and Handling, comprend un passage sur la pression partielle de HCN pour les solutions aqueuses de HCN à diverses concentrations et températures. Ces valeurs sont des valeurs d’équilibre. Cela signifie qu’à ces concentrations, le taux de HCN en phase gazeuse absorbé dans la solution est exactement compensé par le taux de HCN quittant la solution dans la phase gazeuse.
Le graphique montre les valeurs d’équilibre. Il contient implicitement la valeur des coefficients de partage, c'est-à-dire qu’il est possible d’obtenir la concentration d’équilibre de HCN en solution dans l’eau exposée à HCN en phase gazeuse à une concentration et une température données. Cette annexe expose ses valeurs. Dans le livre de DuPont, la concentration de la phase liquide est exprimée en pourcentage du poids et la concentration en phase gazeuse en millimètres mercure (Torr). Il en est déduit des relations en termes de molarité (M) et en grammes par mètre cube (g/m3).
Ces valeurs sont des valeurs d’équilibre, ce qui signifie qu’elles constituent une limite supérieure quant à la concentration qui peut être observée dans l’eau exposée à HCN. Le temps nécessaire pour atteindre cet équilibre est une question de cinétique. Il s’agit d’un problème beaucoup plus ardu.
En lisant les valeurs pour une température donnée, on peut établir une relation entre le poids en pourcentage de HCN dans l’eau en fonction de la concentration en phase gazeuse (exprimée en Torr). La relation est linéaire aux niveaux qui nous intéressent, de telle sorte qu’on peut en déduire les valeurs intermédiaires avec une régression linéaire (méthode des moindres carrés). A 0 Torr, la concentration dans l’eau doit être de 0%. Par conséquent, il n’y a qu’un seul paramètre libre : la pente. Cette relation linéaire répond à la loi de Henry et la pente peut être connue avec la constante de la loi de Henry.
Figure I.1
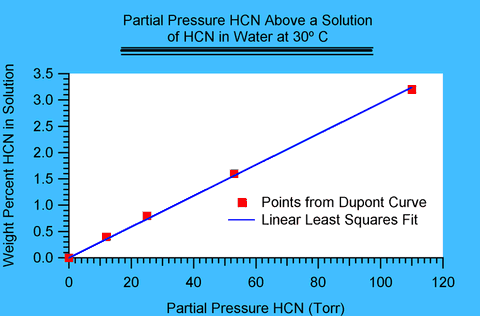
Figure 1. L’ajustement avec la ligne est excellente et propre à moyenner les légères déviations dans les estimations des valeurs fournies par DuPont. La pente suit une relation de 0,029 pour cent/Torr.
Dépendance à la température
Des relevés ont été faits pour 0, 10, 20, 30, 40 et 50 en degrés Celsius (°C). Les valeurs de la pente sont les suivantes :
| Tableau 1 - Pente de la partition gaz-liquide en fonction de la température |
||
|---|---|---|
| Température en °C |
Pente en %/Torr |
|
| 0 | 0.105 | |
| 10 | 0.066 | |
| 20 | 0.047 | |
| 30 | 0.029 | |
| 40 | 0.020 | |
| 50 | 0.013 | |
Conversion d’unités
Le problème est maintenant résolu, à l’exception des conversions d’unités. La concentration de DuPont en phase liquide est exprimée en % du poids. Si je veux exprimer cette valeur en molarité (M), la première étape consiste à calculer le volume d’eau contenant 1 mole de HCN. La masse molaire de HCN est 27,03 g. La masse d’eau (MH2O) peut donc être exprimée comme suit :
(MH2O) = (100/C -1) x 27.03
où C est la concentration en HCN en % du poids. La densité de l’eau est de 1,0 g/ml et sera traitée ici comme indépendante de la température. La densité de HCN en fonction de la température a été trouvée par une extrapolation linéaire des densités observées à la page 2 du document de DuPont. L’ajustement en g/ml aboutit à ce résultat :
pHCN=0.715-0.00133 x T
où T est exprimé en degrés Celsius, et pHCN est la densité de HCN. Le volume de solution qui contient 1 mole de HCN peut maintenant être calculé, si on néglige l’effet du mélange sur la petite modification du volume. La figure 11 (page 31) du manuel de DuPont affiche la densité spécifique des solutions de HCN en fonction du pourcentage en poids de HCN. La lecture de cette figure est suffisante pour montrer que la non prise en compte du volume du mélange est justifiée. Le volume de la solution en millilitres (ml) qui contient 1 mole de HCN est donc :
V= 27.03/pHCN + MH2O/1.0
Il nous reste à effectuer la conversion en concentration molaire, ce qui nous donne :
[HCN] = 1000/V
Les concentrations en phase gazeuse de la chambre à gaz étaient de l’ordre de 8-16 g/m3. J’ai donc choisi une matrice à partir de 1-20 g/m3, converti cette matrice en Torr et calculé à partir des relations ci-dessus, la concentration d’équilibre en eau à des températures données. La conversion de g/m3 est simple :
P=R x T x (C/27.03) x (760/101325)
Ici P est la pression partielle de HCN en Torr, R est la constante des gaz (8,31441 m3 Pa/mole K (unités SI), T est la température en Kelvin (273,15 de plus que la température exprimée en degrés Celsius), C est la concentration de HCN exprimée en g/m3 et 27,03 est la masse molaire de HCN en grammes (pas les unités SI). Il y a 760 Torr dans une atmosphère et 101,325 pascals (Pa).
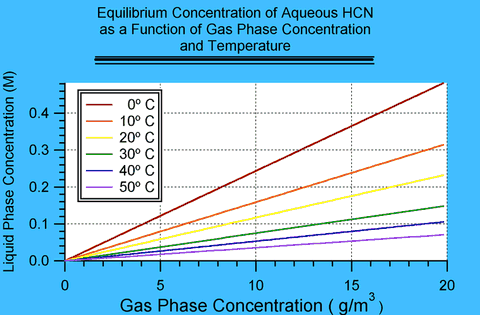
Résultats
Les résultats de ces calculs sont montrés à la figure 2. La température dans les chambres à gaz était probablement comprise entre 20 et 40°C, mais même si elle est descendue à 10 °C, et même en supposant que les concentrations de HCN les plus élevées aient été utilisées, la concentration d’équilibre de HCN est de l’ordre de 0,1-0,2 M. En d’autres termes, ce sont les concentrations maximales qui pourraient être obtenues. Il est plus probable que la concentration a été limitée par la cinétique et que l’équilibre n’a jamais été atteint.Figure I.2
![]()
Revenir à l'article Leuchter, Rudolf et les bleus de Prusse
Notes.
1. DuPont, Hydrogen Cyanide: Properties, Uses, Storage and Handling, 195071A (1991).
[ Article | Germar Rudolf | Négationnisme et réfutations | Toutes les rubriques ]